Research Group for Nano Structuring and Bio-Analytics (NASAN)
Das Hauptforschungsgebiet von NASAN ist die Entwicklung von Methoden zur quantitativen Analyse von biochemischen und biologischen Systemen.
Unsere Gruppe hat langjährige Erfahrung in der Einzelmolekül-Fluoreszenzmikroskopie, der Rasterkraftmikroskopie und der Hochgeschwindigkeits-Rasterkraftmikroskopie, der Quarzkristallmikrowaage sowie der 2D/3D-Nanolithographie. Wir verfügen über ein Zellkulturlabor (BSL 2) und ein gut ausgestattetes chemisches Standardlabor mit Möglichkeiten zur Proteinanalyse.
Methodenentwicklung
NASAN konzentriert Know-how auf Einzelmolekül-Fluoreszenzmikroskopie, Rasterkraftmikroskopie und Hochgeschwindigkeits-Rasterkraftmikroskopie, Quarzkristallmikrowaage sowie 2D/3D-Nanolithographie. Wir sind daran interessiert, diese nanotechnologischen Methoden zur qualitativen und quantitativen Erforschung biologischer Systeme unterschiedlichen Komplexitätsgrades zu kombinieren, von der Dynamik einzelner Proteine bis hin zum Verhalten komplexer Gewebe.
Die 3D-Nanolithografie ist das einzige Werkzeug, das eine 3D-Strukturierung mit Strukturgrößen von Mikro- bis Nanometern ermöglicht. Wir verwenden unsere Lithografiesysteme für die Modifizierung von mikrofluidischen Kanälen, die Strukturierung von 3D-Gewebegerüsten sowie für leitfähige Strukturen. Darüber hinaus setzen wir maskenlose UV-Lithographie für großflächige 2D-Mikrodrucke ein.
Quantitative Rasterkraftmikroskopie (AFM) und Hochgeschwindigkeits-Rasterkraftmikroskopie (HS-AFM) werden zur Untersuchung der Topografie, der mechanischen Eigenschaften und der molekularen Dynamik im Nanobereich eingesetzt. Mit der HS-AFM können wir insbesondere die Struktur und den Oligomerisierungsgrad von Proteinen, die Translations- und Konformationsdynamik, sowie die Bindungskinetik die die Assoziation/Dissoziation mit Bindungspartnern steuert, bestimmen. Quantitatives AFM ermöglicht es uns außerdem, Proben (von einzelnen Proteinen bis hin zu Zellen und Gewebe) hinsichtlich ihrer quantitativen nanomechanischen und Adhäsionseigenschaften zu charakterisieren.
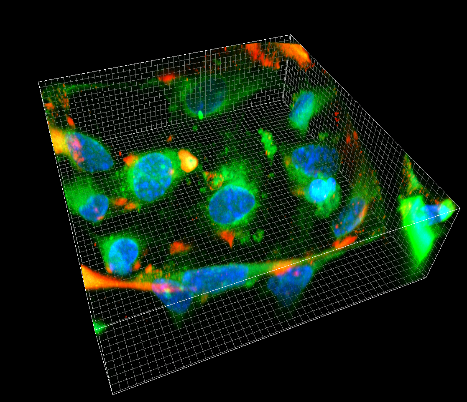
Die mehrfarbige 3D-Superresolution Mikroskopie ist eine Methode, um biologischer Vorgänge in einzelnen Zellen nanoskopisch zu charakterisieren. Mittels dieser Technik und der vergleichende 3D-Bildanalyse ist es möglich verschiedene Zustände einer Zelle auf nanoskopischer Ebene zu unterscheiden, durch 3D-Single Molecule Tracking kann die Dynamik einzelner Moleküle innerhalb von Zellen quantifiziert werden und durch die quantitative Analyse der Intensität einzelner Emitter kann die Häufigkeiten von bestimmten Proteinen in Zellen bestimmen werden.
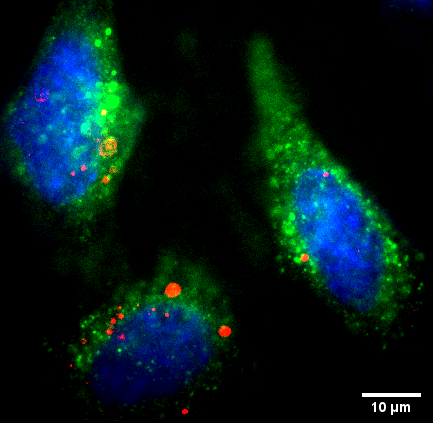
Quantifikation von Bio-Nano-Partikeln
Wir quantifizieren verschiedene Arten von Bio-Nanopartikeln (Antikörper, High-Density/Low-Density-Lipoprotein-Partikel, extrazelluläre Vesikel usw.) im Hinblick auf ihre Wechselwirkungen, ihre Form/Geometrie/ihren oligomeren Zustand, ihre Lipid-/Proteinzusammensetzung sowie ihre zelluläre Aufnahme und ihre nachgeschalteten Effekte.Wir setzen die quantitative Rasterkraftmikroskopie ein, um die Topografie und die mechanischen Eigenschaften von Bio-Nanopartikeln (BNP) zu untersuchen, nutzen die Hochgeschwindigkeits-Rasterkraftmikroskopie, um die molekulare Dynamik und die zugrundeliegenden Wechselwirkungen direkt zu visualisieren, und quantifizieren die Häufigkeit von fluoreszenzmarkierten Proteinen in BNP. Die mehrfarbige 3D-Superresolution Mikroskopie in Kombination mit der quantitativen 3D-Bildanalyse ermöglicht es uns außerdem, biologische Vorgänge in einzelnen Zellen nanoskopisch abzubilden und verschiedene Zustände einer Zelle auf nanoskopischer Ebene zu vergleichen.
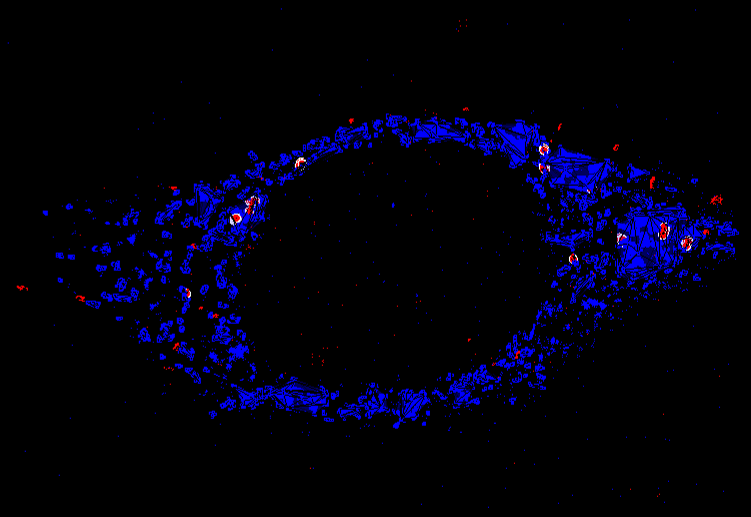
3D-Gewebegerüste in der Mikrofluidik
In NASAN entwickeln wir mikroskopisch kleine 3D-Gewebegerüste für die 3D-Zellkultur, die in kleine mikrofluidische Geräte passen. Auf diese Weise ahmen wir komplexe Systeme wie die Blut-Hirn-Schranke nach und verwenden hochauflösende Fluoreszenzmikroskopietechniken, um Transportprozesse zwischen den verschiedenen Zellschichten zu überwachen.
3D-Gewebegerüste werden mit 3D-Multiphotonenlithographie gedruckt und bestehen aus funktionellen Polymeren. Dies ermöglicht die Abstimmung der mechanischen Eigenschaften, die Beschichtung der Strukturen mit Proteinen und die Verbesserung der Biokompatibilität. Zur quantitativen Analyse kombinieren wir die Mikrofluidik mit der mehrfarbigen, einzelmolekülsensitiven Fluoreszenzmikroskopie, die die Darstellung molekularer Ko-Lokalisationen, die 3D-Verfolgung von Uptake-Ereignissen und die Quantifizierung molekularer Prozesse auf der Nanometerskala ermöglicht. Kürzlich haben wir ein Zweikanal-Mikrofluidiksystem entwickelt, das die Blut-Hirn-Schranke nachahmt - ein 3D-Gerüst, das zur Untersuchung der Thrombusebildung und zur Verwendung als 3D-Proteinchip verwendet wird.

Proteindynamik
Wir charakterisieren das Zusammenspiel von Antikörpern, Komplementproteinen und Fc-Rezeptoren, die immunologische Effektorfunktionen auslösen.
Wir setzen verschiedene biophysikalische Techniken ein, um die Interaktion von Proteinen zu charakterisieren, die an verschiedenen immunologischen Prozessen wie der Aktivierung des Komplementsystems und der antikörperabhängigen zellvermittelten Zytotoxizität beteiligt sind. Mit Hilfe der Hochgeschwindigkeits-Rasterkraftmikroskopie können wir diese Prozesse auf antigenen Membranen mit Nanometern Orts- und Millisekunden Zeitauflösung direkt beobachten, während komplementär dazu Einzelmolekül-Kraftspektroskopie, Quarzkristall-Mikrowaage und Oberflächenplasmonenresonanz kinetischen Reaktionsraten, Affinitäten sowie Wechselwirkungskräfte und Energien liefern.
Die Kombination dieser Methoden ermöglicht es uns, die jeweiligen molekularen Signalwege im Detail zu charakterisieren, komplexe Modelle davon zu erstellen und Computersimulationen durchzuführen, um unser Verständnis der räumlichen und zeitlichen Beziehungen von Proteinen, die eine bestimmte Immunreaktion auslösen oder hemmen, weiter zu vertiefen. Unser übergeordnetes Ziel ist es dieses Wissen zu nutzen, um Möglichkeiten innerhalb der molekularen Signalwege zu identifizieren in denen hemmende Faktoren oder Medikamente den eigentlichen Prozess stören oder verstärken können – und so die präklinische Entwicklung von Medikamenten zur Modulation des Komplementsystems sowie Immun-Effektorzellen im Rahmen von Immuntherapien zu unterstützen.

Kontakt
Forschungsgruppe NASAN




Test

Quick Links
Ich helfe dir bei der Studienwahl.